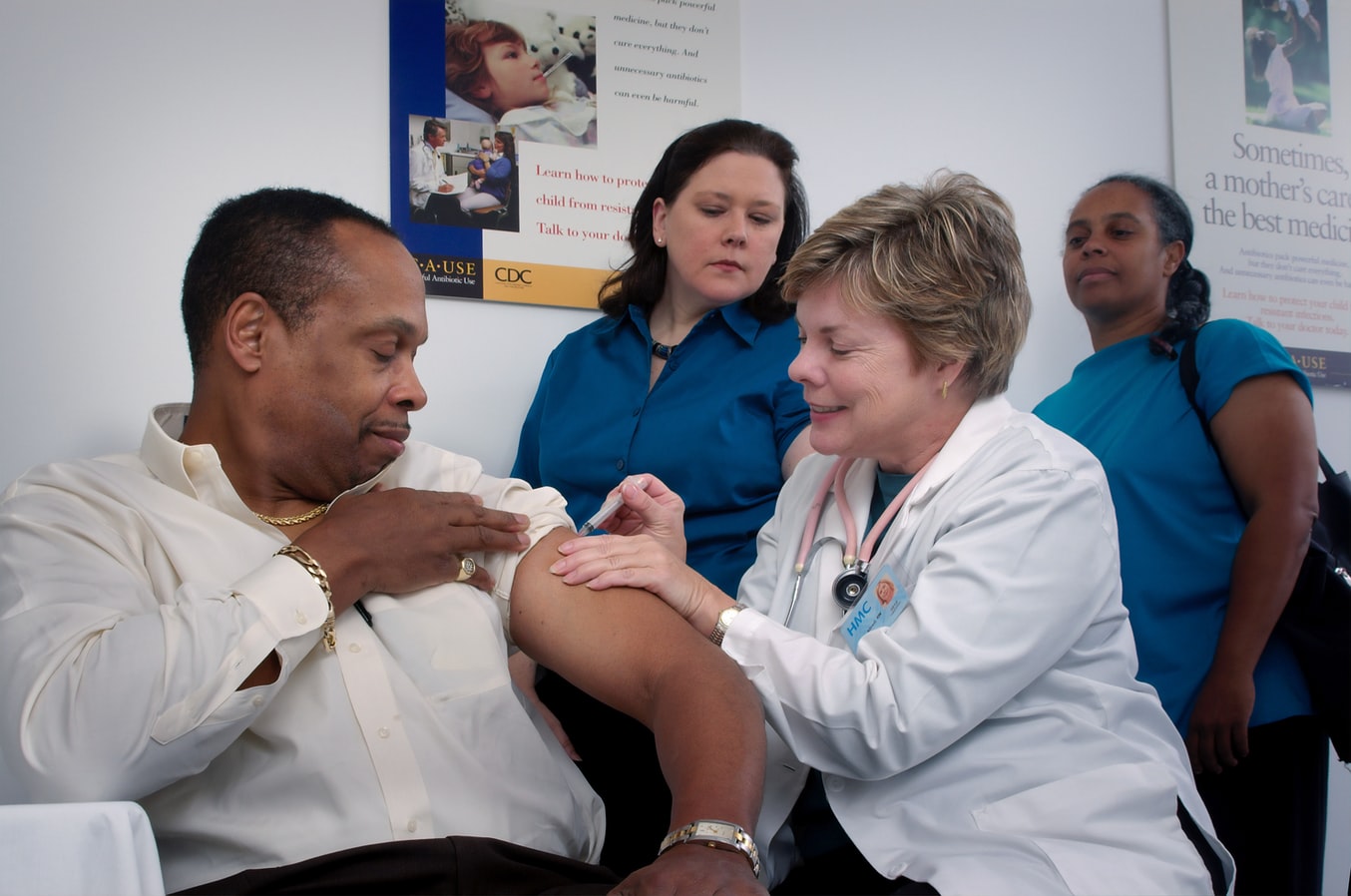
Εμβόλιο κορονοϊού Βρετανία: Οι βρετανικές αρχές σπεύδουν να προειδοποιήσουν να μην κάνουν το εμβόλιο όσοι έχουν σοβαρές αλλεργίες.
Εμβόλιο κορονοϊού Βρετανία: Στο Ηνωμένο Βασίλειο ξεκίνησαν χθες οι μαζικοί εμβολιασμοί κατά του κορονοϊού, με μία 90χρονη να γίνεται το πρώτο άτομο που κάνει το εμβόλιο της Pfizer εκτός του πλαισίου των δοκιμών και παροτρύνοντας τον κόσμο να ακολουθήσει το παράδειγμά της. Ωστόσο σήμερα οι βρετανικές αρχές σπεύδουν να προειδοποιήσουν να μην κάνουν το εμβόλιο όσοι έχουν σοβαρές αλλεργίες. H Ρυθμιστική Υπηρεσία Φαρμάκων και Προϊόντων Υγειονομικής Περίθαλψης (MHRA) εξέδωσε την προειδοποίηση αφότου δύο μέλη του προσωπικού του Εθνικού Συστήματος Υγείας της Βρετανίας (NHS) που εμβολιάστηκαν χθες υπέστησαν αλλεργική αντίδραση. Tα δύο μέλη του προσωπικού είχαν σημαντικό ιστορικό αλλεργικών αντιδράσεων – στο βαθμό που είχαν μαζί τους ένεση αδρεναλίνης. Ανέπτυξαν συμπτώματα «αναφυλαξίας» λίγο μετά την λήψη του εμβολίου.
H Ρυθμιστική Αρχή έχει δώσει προληπτικές συμβουλές στο NHS ότι όποιος έχει ιστορικό «σημαντικών» αλλεργικών αντιδράσεων σε φάρμακα, τρόφιμα ή εμβόλια, καλύτερα να μην κάνει το εμβόλιο της Pfizer. Αυτό σημαίνει ότι οποιοσδήποτε είναι προγραμματισμένο να εμβολιαστεί σήμερα, θα ερωτηθεί για το ιστορικό αλλεργικών αντιδράσεων. Ο καθηγητής Στέφεν Πόουις, εθνικός ιατρικός διευθυντής του NHS στην Αγγλία, δήλωσε: «Όπως συμβαίνει με τα νέα εμβόλια, το MHRA έχει συμβουλεύσει προληπτικά πως άτομα με σημαντικό ιστορικό αλλεργικών αντιδράσεων, δεν θα λάβουν αυτό το εμβόλιο». Όσο για τους δύο εργαζομένους που παρουσίασαν χθες αλλεργικές αντιδράσεις, πρόσθεσε πως «και οι δύο αναρρώνουν καλά».
Οι συμβουλές του MHRA αναφέρουν: «Κάθε άτομο με ιστορικό σημαντικής αλλεργικής αντίδρασης σε ένα εμβόλιο, φάρμακο ή τροφή (όπως προηγούμενο ιστορικό αντίδρασης αναφυλαξίας ή εκείνων που έχουν συμβουλευτεί να φέρουν μαζί τους αδρεναλίνη) δεν πρέπει να λάβει το εμβόλιο των Pfizer/BioNTech. Οι συσκευές ανάνηψης πρέπει να είναι διαθέσιμες ανά πάσα στιγμή για όλους τους εμβολιασμούς. Ο εμβολιασμός πρέπει να πραγματοποιείται μόνο σε εγκαταστάσεις όπου υπάρχουν συσκευές ανάνηψης».
Αύριο κρίνεται η άδεια για το εμβόλιο της Pfizer στις ΗΠΑ
Από εκεί και πέρα στη δημοσιότητα χθες από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ η έκθεση που θα κληθεί να εξετάσει, αύριο Πέμπτη 10 Δεκεμβρίου η Συμβουλευτική Επιτροπή Εμβολίων και Σχετικών Βιολογικών Προϊόντων (VRBPAC) για να γνωμοδοτήσει για τη χορήγηση ή όχι Άδειας Χρήσης Έκτακτης Ανάγκης (EUA) στο εμβόλιο BNT162b1 των Pfizer/BioNTech. Στις 53 σελίδες του εγγράφου εμπεριέχονται λεπτομερείς πληροφορίες που εμμέσως πλην σαφώς «δείχνουν» τον δρόμο για την έγκριση του BNT162b1 προκειμένου να επιτευχθεί η ανοσοποίηση του πληθυσμού έναντι της νόσου COVID-19.
Η δημοσιοποίηση του εγγράφου δύο ημέρες πριν από τη συνεδρίαση της VRBPAC ερμηνεύεται ως «έμμεση έγκριση», αν και είναι γνωστό ότι ο FDA δεν δεσμεύεται από τις γνωμοδοτήσεις των συμβουλευτικών επιτροπών. Ωστόσο, μέλη του FDA σε χθεσινές τους δηλώσεις στα αμερικανικά μέσα ενημέρωσης ανέφεραν ότι τα στοιχεία που κατέθεσαν οι Pfizer και BioNTech συμβαδίζουν με την οπτική του ρυθμιστικού φορέα για επείγουσα αδειοδότηση.
Pfizer COVID Vaccine. Amazing! The numbers speak for themselves. I’m sure Moderna has similar numbers. One of the greatest achievements in medicine of all time. I’m all in. @ASlavitt pic.twitter.com/WqAmjKjZV6
— Vincent Rajkumar (@VincentRK) December 8, 2020
Τι θα συζητήσει η συμβουλευτική επιτροπή
Η VRBPAC συνεδριάζει, λοιπόν, αύριο Πέμπτη για να συζητήσει και να κάνει συστάσεις αν «με βάση το σύνολο των διαθέσιμων επιστημονικών στοιχείων, είναι λογικό να πιστεύουμε ότι το εμβόλιο των Pfizer-BioNTech για την COVID-19 μπορεί να είναι αποτελεσματικό στην πρόληψη της νόσου σε άτομα ηλικίας 16 ετών και άνω» αναφέρεται χαρακτηριστικά στη θεματολογία της συνεδρίαση, καθώς και αν «τα γνωστά και πιθανά οφέλη του, υπερτερούν των γνωστών και πιθανών κινδύνων για χρήση σε άτομα ηλικίας 16 ετών και άνω».
Η Επιτροπή θα συζητήσει επίσης ποιες πρόσθετες μελέτες πρέπει να διεξαχθούν τους κατασκευαστές του εμβολίου μετά την έκδοση της EUA για τη συλλογή περαιτέρω δεδομένων σχετικά με την ασφάλεια και αποτελεσματικότητα αυτού του εμβολίου. Πάντως, ανεξαρτήτως του ποιο θα είναι το γνωμοδοτικό πόρισμα της VRBPAC ο FDA θα είναι αυτός που θα λάβει την τελική απόφαση για την έγκριση ή όχι του BNT162b1. Η 53σελιδη πάντως έκθεση περιέχει τόσο ισχυρά στοιχεία για την αποτελεσματικότητα και ασφάλεια του που θεωρείται απίθανο να μην του δοθεί EUΑ, ενώ μάλιστα έχει ήδη εγκριθεί στο Ηνωμένο Βασίλειο και ο εμβολιασμός εκεί είναι από χθες σε εξέλιξη.
Here is the link to the full FDA briefing document. A lot it detail in here. https://t.co/NQrWk7Jxpe
— Vincent Rajkumar (@VincentRK) December 8, 2020
Πηγή κεντρικής φωτο: unsplash